《先进储能材料制备技术实验》课程大纲
一、课程基本信息
英文名称 | Preparation experiment of advanced energy storage materials | 课程代码 | MDNE2031 |
课程性质 | 开放选修课程 | 授课对象 | yl7703永利官网本科生 |
学 分 | 2 | 学 时 | 36 |
主讲教师 | 张丽亚 | 修订日期 | |
指定教材 | 《先进储能材料制备技术实验》讲义 | ||
二、教学内容
第一章 水热法制备Co3O4及其超级电容性能测量
1. 教学方法: 实验
2. 教学手段: 多媒体
3. 教学重点: 水热法合成纳米材料的实验步骤和比电容的计算方法
4. 教学难点: Co3O4的水热合成原理
5. 作业布置: 实验报告
6. 大纲要求: 熟练掌握 Co3O4的合成步骤和比电容计算方法
7. 基本内容:
一、实验目的
(1)了解Co3O4的水热法合成原理
(2)熟悉Co3O4的合成实验设备和电容性测量仪器
(3)掌握Co3O4的合成步骤和比电容计算方法
二、实验原理
水热合成法是指温度为100~1000℃、压力为1MPa~1GPa 条件下利用水溶液中物质化学反应进行合成的方法。在亚临界和超临界水热条件下,由于反应处于分子水平,反应活性提高,因而水热反应可以替代某些高温固相反应。又由于水热反应的均相成核及非均相成核机理与固相反应的扩散机制不同,因而可以创造出其它方法无法制备的新化合物和新材料。
超临界水的概念:当气压和温度达到一定值时,因高温而膨胀的水的密度和因高压而被压缩的水蒸气的密度正好相同时的水。此时,水的液体和气体便没有区别,完全交融在一起,成为一种新的呈现高压高温状态的液体。超临界水具有强的反应活性,同时可以与油等物质混合,具有较广泛的融合能力。超临界水具有完全溶解有机物,完全溶解空气和氧气,完全溶解气相反应反应的产物和对无机物溶解度不高等特点。
水热合成法的主要特点有:
1. 在水溶液中离子混合均匀;
2. 水随温度升高和自生压力增大变成一种气态矿化剂,具有非常大的解聚能力。水热物系在有一定矿化剂存在下,化学反应速度快,能制备出多组份或单一组份的超微结品粉末;
3. 离子能够比较容易地按照化学计量反应,晶粒按其结晶习性生长,在结晶过程中,可把有害杂质自排到溶液当中,生成纯度较高的结晶粉末。
水热合成按反应温度分类
低温水热合成:100℃以下,可用于沸石等的合成;
中文水热合成:100-300℃,经济有效的合成区域;
高温高压水热合成:300℃以上,主要用于单晶生长及特种结构的化合物合成;


水热法制备Co3O4纳米颗粒的流程图
三.主要仪器与药品
1. 仪器
五位天平,50ml水热反应釜,超声波清洗机,恒温箱,高速离心机,高温管式炉,量筒
2. 药品
六水合氯化钴0.6g,尿素1.8g ,超纯水8ml,泡沫镍
四.操作步骤
(1)使用五位天平,精确称量0.6g六水合氯化钴和1.8g尿素;
(2)将称量好的原料放入50ml聚四氟乙烯高压反应釜内胆中,再用量筒量取适量超纯水加入上述反应釜内胆中;
(3)将反应釜内胆放入超声波清洗机中超声,直到反应物充分溶解并良好分散,整个过程约需要10分钟;
(4)将反应釜内胆用生料带密封,盖紧盖子,然后放入反应釜中;
(5)设定水热反应温度75℃,时间15小时,将水热反应釜放入恒温箱中进行水热反应;
(6)反应结束后,离心清洗产物,并用恒温箱干燥。
五.注意事项
(1)水热釜内胆需用酒精润洗干净并吹干。
(2)反应物加入反应釜内胆底部尽量避免粘到内壁上.。
(3)将反应釜内胆放入水热反应釜后,一定要确保拧紧水热反应釜,否则内胆内的气流会溢出,无法保证高压条件,进而无法确保能否合成目标产物。
(4) 水热反应结束后,应待水热反应釜冷却至室温再打开。
六.思考题
1. 制备Co3O4纳米颗粒有哪些方法?
2. 水热反应为什么适合合成无机纳米材料?
3. 实验中泡沫镍和尿素的作用分别是什么?
第二章 高温固相法制备锂离子电池Li4Ti5O12负极材料
1. 教学方法: 实验
2. 教学手段: 多媒体
3. 教学重点: 高温固相法制备锂离子电池Li4Ti5O12的合成步骤和原理
4. 教学难点: Li4Ti5O12的合成原理
5. 作业布置: 实验报告
6. 大纲要求: 高温固相法制备Li4Ti5O12的合成步骤和原理
7. 基本内容:
一.实验目的
1. 了解锂离子电池的应用和Li4Ti5O12负极材料的结构、特点
2. 熟悉Li4Ti5O12负极材料的固相制备方法和粉体材料电导率测试原理和方法
3. 掌握前驱物制备流程、实验步骤以及管式炉和四探针电极的操作方法
二.实验原理
高温固相法制备Li4Ti5O12负极材料的原理:
Li4Ti5O12为尖晶石结构,空间群为Fd3m,可以为锂离子提供三维扩散通道。锂离子在Li4Ti5O12 的脱嵌是一个高度可逆的两相转变过程。在脱嵌锂过程中,尖晶石内部八面体16d位置的锂离子和钛离子不受锂离子脱嵌影响,所以随着锂的嵌入,Li4Ti5O12晶格常数和体积变化小,因此被称为“零应变”材料。尖晶石型的钛酸锂作为锂离子电池负极材料,在充放电过程中体积变化小、充放电电压稳定、热稳定性好和安全性好等特性,有望成为新一代动力锂离子电池负极材料。
高温固相合成是指在高温(1000~1500℃)下,固体界面间经过接触,反应,成核,晶体生长反应而生成一大批复合氧化物,如含氧酸盐类、二元或多元陶瓷化合物等。高温固相法是一种传统的制粉工艺,虽然有其固有的缺点,如能耗大、效率低、粉体不够细、易混入杂质等,由于该法制备的粉体颗粒无团聚、填充性好、成本低、产量大、制备工艺简单等优点,迄今仍是常用的方法。
Li4Ti5O12负极材料电导率的测定:电导率为电阻率的倒数,本实验采用四探针测试仪测试电阻率的方法求算其电导率。
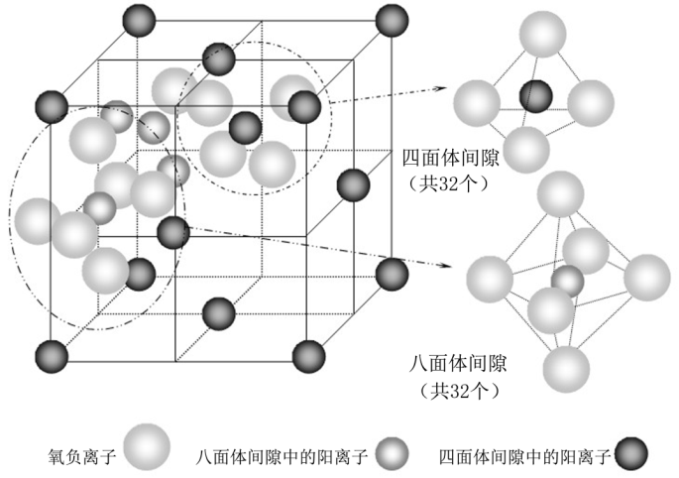
三.主要仪器与药品
碳酸锂,二氧化钛,天平,药匙,无水乙醇,研钵,坩埚,马弗炉,压片机,四探针测试仪,红外
四.实验步骤
2Li2CO3+5TiO2→Li4Ti5O12+2CO2↑
按n(Li)/n(Ti) = 4:5称取一定量的碳酸锂和二氧化钛。其中,为了避免锂盐在高温过程中的挥发对目标产物的影响,实验中锂盐过量5mol%。以无水乙醇为分散剂,将所称得原料在研钵中研磨混合均匀,烘干装入坩埚,压实。然后,置于马弗炉中,空气条件下于750℃下煅烧12h后,冷却至室温得到白色Li4Ti5O12负极材料。
称量0.006mol的碳酸锂和0.015mol的二氧化钛,锂盐过量5%,即分别为0.0063mol和0.015mol;
m(碳酸锂)=0.0063*73.89=0.465 g
m(二氧化钛)=0.015*79.9=1.19 g
五.注意事项
高温固相法中制备Li4Ti5O12材料中,原料要研磨混合均匀。
导率测试时,为了使前期压片理想,材料一定要研磨细腻。
六. 思考题
影响固相法制备Li4Ti5O12材料的因素有哪些?
列举制备Li4Ti5O12负极材料的方法?
第三章 溶胶-凝胶法制备纳米TiO2微粒
1. 教学方法: 实验
2. 教学手段: 多媒体
3. 教学重点: 溶胶凝胶法的原理和实验步骤
4. 教学难点: TiO2的溶胶凝胶法合成原理
5. 作业布置: 实验报告
6. 大纲要求: 熟练掌握溶胶凝胶法合成TiO2的原理
7. 基本内容:
一、实验目的
1. 用溶胶-凝胶法制备纳米TiO2微粉。
2.掌握溶胶-凝胶法制备纳米粒子的原理。
3.了解纳米粒子常用的表征手段。
二.实验原理
溶胶-凝胶法(Sol
Gel法)是指无机物或金属醇盐经过溶液、溶胶、凝胶而固化,再经热处理而成的氧化物或其它化合物固体的方法。溶胶是指微小的固体颗粒悬浮分散在液相中,并且不停的进行布朗运动的体系。由于界面原子的Gibbs自由能比内部原子高,溶胶是热力学不稳定体系。凝胶是指胶体颗粒或高聚物分子互相交联,形成空间网状结构,在网状结构的孔隙中充满了液体(在干凝胶中的分散介质也可以是气体)的分散体系。并非所有的溶胶都能转变为凝胶,凝胶能否形成的关键在于胶粒间的相互作用力是否足够强,以致克服胶粒-溶剂间的相互作用力。对于热力学不稳定的溶胶,增加体系中粒子间结合所须克服的能垒可使之在动力学上稳定。因此,胶粒间相互靠近或吸附聚合时,可降低体系的能量,并趋于稳定,进而形成凝胶。
钛酸四丁酯的水解反应为分步水解,方程式为:
Ti(OR)n+H2O Ti(OH)(OR)n-1+ROH
Ti(OH)(OR)n-1+H2O Ti(OH)2(OR)n-2+ROH
……
反应持续进行,直到生成Ti(OH)
缩聚反应:
—Ti—OH+HO—Ti— —Ti—O—Ti+H2O
—Ti—OR+HO—Ti— —Ti—O—Ti+ROH
最后获得氧化物的结构和形态依赖于水解与缩聚反应的相对反应程度,当金属-氧桥-聚合物达到一定宏观尺寸时,形成网状结构从而溶胶失去流动性,即凝胶形成。
以钛酸四丁酯为前驱物,无水乙醇为溶剂,冰醋酸为螯合剂,控制钛酸四丁酯均匀水解,减少水解产物的团聚,得到颗粒细小且均匀的二氧化钛溶胶。
三.主要仪器与药品
1. 仪器:电磁搅拌器,鼓风干燥箱,马弗炉, TG/DTA 热重/差热分析仪;X射线衍射仪 XRD;FEI扫描电镜
2. 试剂:钛酸丁酯,无水乙醇,冰醋酸
四.操作步骤
1. 室温下将5mL钛酸四丁酯缓慢倒入25mL无水乙醇,磁力搅拌5分钟,得到均匀透明的黄色溶液(1);
2. 将5mL冰醋酸加入到5mL蒸馏水与20mL无水乙醇中,剧烈搅拌,控温45℃左右,得到溶液(2);
3. 在剧烈搅拌条件下,使用滴管将溶液(1)缓慢滴加到溶液(2)中,约10min滴完,得到均匀透明的溶胶,整个过程控温45℃左右 ;
4. 继续搅拌10min后,在室温下静置,待形成透明凝胶后,80℃下真空干燥,玛瑙碾磨,得到干凝胶粉末,再在600℃下于高温炉中煅烧2h便得到TiO2纳米粉体。
5. 将干燥后产物用TG/DTA热重/差热分析仪进行热分析,条件:空气气氛,升温速率为10℃/min,温度范围为室温至600℃。将煅烧后样品进行XRD和SEM测试,分析样品的形貌和晶体结构。
五.注意事项
1.整个操作过程中不要让溶液沸腾!!!
2.实验用到的烧杯、磁子和量筒等一定要清洗干净,再烘干使用。
3. 滴管滴加溶液的过程一定要慢!
六.思考题
溶胶-凝胶法制备纳米氧化物过程中,哪些因素影响产物的粒子大小及其分布?
表面化学角度考虑,如何减少纳米粒子在干燥过程中的团聚?
溶胶凝胶法制备二氧化钛有哪些优点?
第四章 共沉淀法制备TiO2光催化剂及其光催化性能的测定
1. 教学方法: 实验
2. 教学手段: 多媒体
3. 教学重点: 共沉淀法的原理和实验步骤
4. 教学难点: TiO2的合成原理
5. 作业布置: 实验报告
6. 大纲要求: 熟练掌握共沉淀法制备TiO2的原理和实验步骤
7. 基本内容:
一、实验目的
1、了解纳米材料制备的一般原理及光催化降解典型有机污染物的原理
2、握纳米材料的结构表征方法
3、握光催化降解典型有机污染物的操作过程和催化性能的评价
二、实验原理
共沉淀法是指在溶液中含有两种或多种阳离子,它们以均相存在于溶液中,加入沉淀剂,经沉淀反应后,可得到各种成分的均一沉淀,它是制备含有两种或两种以上金属元素的复合氧化物超细粉体的重要方法。生成粒子的粒径通常取决于沉淀物的溶解度,沉淀物的溶解度越小,粒径相应的也越小。

用共沉淀法制备纳米TiO2,对其进行结构和光吸收性质的表征,并测定其光催化降解罗丹明6G的性能。 化学反应方程式如下:
Ti(SO4)2 + 4NaOH → TiO2 + 2Na2SO4 + 2H2O
三.主要仪器与药品
仪器:电磁搅拌器,鼓风干燥箱,离心机,马弗炉,X射线衍射仪 XRD,FEI扫描电镜
试剂:硫酸钛,氢氧化钠,氯化钡
四.操作步骤
1、纳米 TiO2的制备:
配制浓度为4mol/L NaOH溶液和0.1 mol/L BaCl2;
将1.5 g 硫酸钛溶解在20 ml蒸馏水中,磁力搅拌,得到Ti(SO4)2溶液;
电磁搅拌下,使用滴管向Ti(SO4)2溶液中缓慢滴加上述NaOH溶液,调节pH值至7左右(使用PH试纸查看是否为7);
离心上述沉淀物,并用蒸馏水洗涤直至无SO42-离子(用0.1 mol/L BaCl2溶液检测);
所得产物在120℃干燥,碾磨后置于马弗炉中升温至500 ℃煅烧2 h,得到白色TiO2粉末。
2、纳米 TiO2光催化活性测试
在紫外光照条件下,以合成的纳米TiO2光催化剂来降解水溶液中的罗丹明6G染料,通过染料浓度随光催化反应时间的降低速率来评价所合成样品的光催化性能。
空白实验以200 mL 浓度为0.1g/L的罗丹明6G溶液为标准,在没有TiO2光催化剂存在的条件下,在紫外灯照射条件下,测试罗丹明6G溶液的吸光度随照射时间的变化。
称取0.2000g催化剂放入200mL 浓度为0.1g/L的罗丹明6G溶液液中,在紫外灯照射下,反应开始后每15分钟从容器中取出5ml反应液,转移入10ml离心试管中进行离心分离,取上层清液,利用紫外-可见吸收光谱仪测定554 nm处的吸光度值,测试罗丹明6G溶液的吸光度随照射时间的变化。
五.注意事项
1.Ti(SO4)2溶液的滴加速度一定要慢。
2. 沉淀物一定要清洗干净,除去杂质。
六.思考题
化学沉淀法制备纳米材料的影响因素有哪些?
如何对化学沉淀法进行优化?
第五章 利用化学气相沉积技术在铜箔等表面生长石墨烯
1. 教学方法: 实验
2. 教学手段: 多媒体
3. 教学重点: 化学气相沉积法的原理和制备步骤
4. 教学难点: 化学气相沉积法的原理
5. 作业布置: 实验报告
6. 大纲要求: 熟练掌握化学气相沉积法制备石墨烯的原理
7. 基本内容:
一. 实验目的:
1、了解化学气相沉积系统的主要组成和使用方法
2、 掌握铜箔的前处理方法
3、 掌握在铜箔上原位化学气相生长的主要步骤
4、了解石墨烯的基本表征方法,以拉曼光谱为例进行讲解
二. 实验原理
CVD:利用甲烷等含碳化合物作为碳源,高温分解,在基体表面生长石墨烯。其生长机理可以分为渗碳析碳机制和表面生长机制。渗碳析碳机制主要原理为,对于Ni等具有较高溶C量的金属基体,碳源裂解产生的碳原子在高温时渗入,温度降低,从基体中析出成核,长大成石墨烯。表面生长机制,对于铜等具有较低的溶C量的金属基体,高温下,气态碳源裂解生成碳原子吸附于表面,生长成石墨烯岛,再二维长大合并得到石墨烯。

CVD三个主要组成因素:
C源;主要为烃类,如甲烷、乙烯、乙炔,选择碳源主要考虑分解温度、分解速度和分解产物三方面。
生长基体:主要包含金属箔,选择依据为:金属的熔点,溶C量,是否有稳定的金属碳化物,另外金属晶体类型及晶体取向也会影响石墨烯的生长。
生长条件:气压为分为常压,低压(105-10-3 Pa)和超低压(小于10-3 Pa)
温度分为高温(大于800℃),中温(600-800℃)和低温(小于600℃)
三. 实验仪器与药品
铜箔,丙酮,盐酸,磷酸和聚乙二醇,去离子水,聚苯乙烯,管式炉,Ar (300 secm)和H2,PMMA,真空干燥箱,过硫酸铵,酒精,拉曼光谱仪
四. 实验步骤:
(1)铜箔的抛光处理
实验中首先对铜箔进行表面机械抛光处理,使铜箔表面形成无划痕的镜面。用丙酮超声清洗机械抛光后的铜箔10 min,然后用25%盐酸超声清洗10min,最后将清洗后的铜箔进行电化学精抛光,以85%磷酸和聚乙二醇(PEG)体积比为3:1的溶液为抛光液,电化学抛光电压范围为I~2 V,将铜箔放置于正极进行抛光1800s。电化学抛光结束后将铜箔经丙酮超声清洗10 min,再用25%盐酸超声清洗10 min,最后用去离子水将铜箔冲洗干净,氮气吹干。
(2)石墨烯的生长
将固态碳源聚苯乙烯放置于管式炉石英管进气端口处,铜箔置于石英管的中部,预抽石英管中的空气,然后通入Ar (300 secm)和H2 (100 sccm)并对炉子进行加热,两种气体保持此速率直至实验结束。石英管先加热到1035℃保持25 min,此过程中铜箔表面铜晶粒长大,高温下铜箔表面原子重排,使表面更加平整。随后将炉温降至生长温度1000℃,同时通入气态碳源或加热固态碳源聚苯乙烯至280℃,反应30 min,最后停止加热使石英管降至室温。
(3)用PMMA转移石墨烯
在铜箔(表面已生长一层石墨烯)表面旋涂一层厚度约500nm的PMMA溶液,之后置于150℃的真空干燥箱中干燥5 min,取出铜箔,将铜箔漂浮于浓度为1.0mol/L的过硫酸铵溶液中反应5h后腐蚀去除铜箔。将去除铜箔后的PMMA/石墨烯转移至目标衬底上,再整体浸泡于丙酮中3h溶解去除PMMA,然后以酒精缓慢清洗以去除残留的丙酮,最后在450℃下退火处理衬底/石墨烯以去除残留的PMMA。
(4)测试与表征
采用拉曼光谱仪对石墨烯微结构进行分析,扫描范围为1200-2900 cm-1。
五.注意事项
1. 做实验前打开通风厨,一定要通风。
2. 安装好气路,先打开氩气检查气路的密闭性,做到不要漏气。
3. 高温过程不可以关掉气体,防止排出口的水倒流入管。
4.铜箔一定要清洗干净。
六.思考题
1. CVD法制备石墨烯的影响因素有哪些?
2. 如何在低温下制备结晶性良好的石墨烯?
第六章 球磨方法制备钛酸锂负极极片
1. 教学方法: 实验
2. 教学手段: 多媒体
3. 教学重点: 钛酸锂负极浆料的混合
4. 教学难点: 钛酸锂极片的制备
5. 作业布置: 实验报告
6. 大纲要求: 熟练掌握钛酸锂负极极片的制备方法
7. 基本内容:
一、实验目的
1. 熟悉球磨方法混合电极材料浆料的过程;
2. 熟悉使用水性粘结剂的操作步骤
3. 掌握涂敷负极极片的相关工艺
4. 学会使用测厚仪计算极片厚度,计算活性物质负载量
二、实验原理
行星式球磨机也叫高能球磨机,是机械合金化和机械活化中最重要的一款仪器。对其工作原理,我们可以通过下图的展示进行一个详细的描述:行星式球磨机都有一个主盘,也叫太阳盘,在主盘上有一个、两个或四个安放研磨碗的底座。当主盘转动时,研磨碗绕主盘轴公转的同时又围绕自身轴心自转,做行星式运动,且其自转方向与转盘转动方向相反。在行星式运动中,研磨碗和主盘旋转所形成的离心力作用在研磨碗内的研磨球和物料上,由于研磨碗和主盘旋转方向相反,所以,离心力在同向与反向间交替发挥作用,结果就是研磨球摩擦研磨碗一侧的内壁(摩擦力粉碎物料),当到达一定强度时,强力撞击另一侧内壁(撞击力粉碎物料),撞击力通过研磨球之间的相互碰撞使其作用增大。物料就是在此强力的冲击力和碾压下,得以粉碎、研磨、分散或混合。
示意图如下:
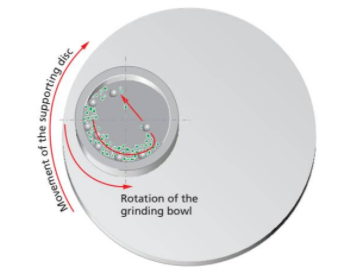

三. 主要仪器与药品
海藻酸钠,钛酸锂,导电剂Super P,去离子水,酒精,NMP,烧杯,磁子,药匙,研钵,行星式球磨机,注射器,铜箔,涂敷机,刮刀,测厚仪,切片机
四.操作步骤
1.海藻酸钠溶液的配置
配置质量分数为2%的海藻酸钠水溶液
取海藻酸钠固体2g于烧杯中,加入98ml去离子水,磁力搅拌溶解。随后磁力搅拌30分钟直至海藻酸钠溶液清澈透亮,具有很好的流动性
2. 活性物质钛酸锂与导电剂Super P混合
采用研磨方法,称量0.96克钛酸锂负极以及0.32克导电剂Super P,充分研磨至两者完全混合均匀,研磨时间约20-25分钟
备注:活性物质,导电剂和粘结剂的质量比为6:2:2,即活性物质负载量为60%。
3. 行星式球磨进行混料
称量1.2克钛酸锂/导电剂Super P混合物,装入球磨罐,使用注射器吸取15克海藻酸钠溶液,加入到上述固体混合物种,使用药勺简单混合。
开机,设置程序,开始混合,搅拌1小时,直至浆料完全均匀混合。
4. 涂膜
将铜箔平整贴附在玻璃表面,中间使用NMP进行连接
调节好涂敷机速度至6-7之间,固定好刮刀,将浆料滴在刮刀前端
打开电源,开始涂膜
涂膜结束后,马上置于烘箱中干燥
5. 膜厚测量和活性物质负载量的计算
将涂好的极片干燥后,使用测厚仪测量极片的厚度,极片厚度减去铜箔的厚度就可以得到电极材料的厚度。使用切片机将极片切成同等大小的圆片后,使用天平称重,减去铜箔的质量就是电极材料的重量。按照活性物质60%的比例进行计算,即可得到钛酸锂的面密度(mg/cm2)。
![]()
五.注意事项
1. 一定要充分搅拌,将海藻酸钠溶液完全溶解。
2. 活性物质钛酸锂与导电剂Super P要用研钵混合研磨充分。
3. 球磨罐一定要安装固定好,防止在高速转动的时候出现意外。
4. 铜箔与玻璃基底之间一定要紧密结合,不要有气泡。
六.思考题
1. 影响混料的因素都有哪些?
2. 为什么两种工艺制备出来的极片负载量有差异?
三、学时分配
章节 | 章节内容 | 学时分配 |
第一章 | 水热法制备Co3O4及其超级电容性能测量 | 6 |
第二章 | 高温固相法制备锂离子电池Li4Ti5O12负极材料 | 6 |
第三章 | 溶胶-凝胶法制备纳米TiO2微粒 | 6 |
第四章 | 共沉淀法制备TiO2光催化剂及其光催化性能的测定 | 6 |
第五章 | 利用化学气相沉积技术在铜箔等表面生长石墨烯 | 6 |
第六章 | 球磨方法制备钛酸锂负极极片 | 6 |
四、教材及参考书
《先进储能材料制备技术实验》讲义
五、教学方法
实验

